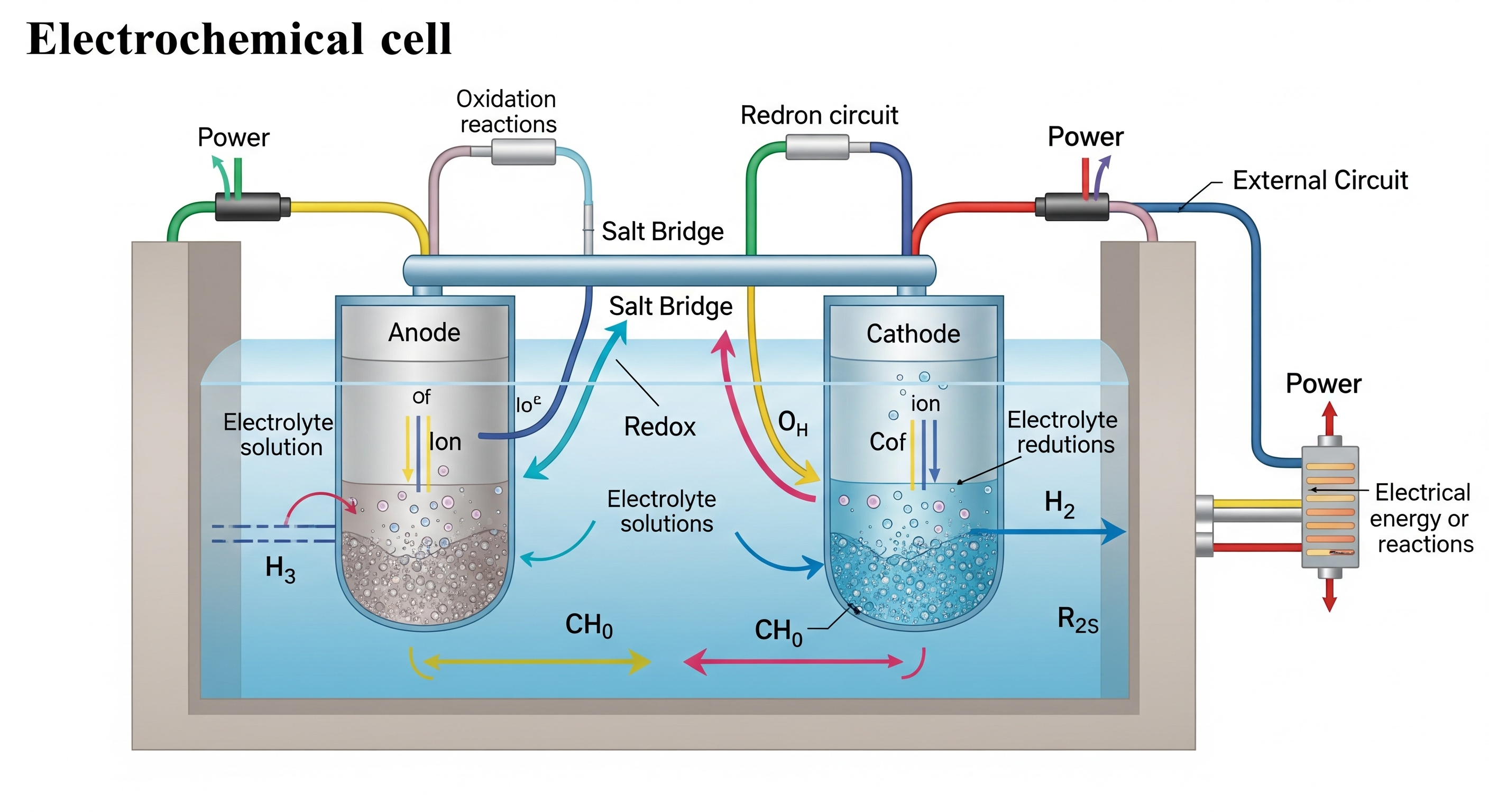
তড়িৎ রসায়ন হল রসায়নের এমন একটি শাখা যেখানে রাসায়নিক বিক্রিয়া এবং তড়িৎ শক্তির মধ্যে সম্পর্ক নিয়ে আলোচনা করা হয়। অর্থাৎ, কিভাবে রাসায়নিক শক্তি তড়িৎ শক্তিতে রূপান্তরিত হয় বা তড়িৎ শক্তির দ্বারা রাসায়নিক বিক্রিয়া সংঘটিত হয় — তাই এই অধ্যায়ের মূল বিষয়বস্তু।
১. পরিবাহিতা (Conductance)
পরিবাহিতা বলতে কোন দ্রবণের মাধ্যমে তড়িৎ প্রবাহের ক্ষমতাকে বোঝায়।
Types of Conductance (পরিবাহিতার প্রকারভেদ)
| প্রকার | সংজ্ঞা | একক |
|---|---|---|
| Specific Conductance (κ) | নির্দিষ্ট আয়তনের দ্রবণে বিদ্যুৎ পরিবহনের ক্ষমতা | S cm⁻¹ |
| Molar Conductance (Λₘ) | এক মোল ইলেকট্রোলাইট দ্রবণের পরিবাহিতা | S cm² mol⁻¹ |
| Equivalent Conductance (Λₑ) | এক ইকুইভ্যালেন্ট দ্রবণের পরিবাহিতা | S cm² eq⁻¹ |
চার্ট: Conductance এর উপর প্রভাব
| পরিবর্তন | Specific Conductance (κ) | Molar Conductance (Λₘ) |
|---|---|---|
| ঘনত্ব কমালে | হ্রাস পায় | বৃদ্ধি পায় |
| তাপমাত্রা বাড়ালে | বৃদ্ধি পায় | বৃদ্ধি পায় |
২. ইলেকট্রোলাইটিক সেল (Electrolytic Cell)
ইলেকট্রোলাইটিক সেলে বাহ্যিক তড়িৎ শক্তির সাহায্যে একটি রেডক্স বিক্রিয়া সংঘটিত হয়।
বৈশিষ্ট্য:
- বাহ্যিক ভোল্টেজ প্রয়োগ করতে হয়।
- অক্সিডেশন হয় অ্যানোডে, রিডাকশন হয় ক্যাথোডে।
- উদাহরণ: Electrolysis of water
চিত্র: Electrolytic Cell
(-) Battery (+)
| |
Cathode Anode
| |
H₂(g) O₂(g)
৩. গ্যালভানিক সেল (Galvanic Cell)
গ্যালভানিক সেলে রাসায়নিক বিক্রিয়া থেকে তড়িৎ শক্তি উৎপন্ন হয়।
বৈশিষ্ট্য:
- এটি নিজে থেকে চলে (Spontaneous reaction)।
- অ্যানোডে অক্সিডেশন এবং ক্যাথোডে রিডাকশন হয়।
- উদাহরণ: Daniel Cell
চার্ট: Galvanic vs Electrolytic Cell
| বিষয় | Galvanic Cell | Electrolytic Cell |
|---|---|---|
| শক্তির উৎস | রাসায়নিক শক্তি → তড়িৎ | তড়িৎ শক্তি → রাসায়নিক |
| প্রতিক্রিয়া | স্বতঃস্ফূর্ত | অস্বতঃস্ফূর্ত |
| অ্যানোড | নেগেটিভ | পজিটিভ |
| ক্যাথোড | পজিটিভ | নেগেটিভ |
৪. ইলেকট্রোড পোটেনশিয়াল (Electrode Potential)
কোনো ইলেকট্রোড যখন দ্রবণে ডুবিয়ে রাখা হয় তখন সেটি তড়িৎ বিভব তৈরি করে — একেই ইলেকট্রোড পোটেনশিয়াল বলে।
স্ট্যান্ডার্ড হাইড্রোজেন ইলেকট্রোড (SHE)
- এটি একটি রেফারেন্স ইলেকট্রোড।
- এর পোটেনশিয়াল ধরা হয় 0.00 V।
৫. Nernst Equation (নার্নস্ট সমীকরণ)
তাপমাত্রার ও ঘনত্বের ভিত্তিতে ইলেকট্রোড পোটেনশিয়াল গণনার জন্য ব্যবহৃত হয়।
E=E∘−0.0591nlogQE = E^\circ – \dfrac{0.0591}{n} \log Q
সংক্ষিপ্ত নোটস:
| বিষয় | তথ্য |
|---|---|
| Conductance | তাপমাত্রা বৃদ্ধিতে বাড়ে |
| Galvanic Cell | স্বতঃস্ফূর্ত প্রতিক্রিয়া |
| Electrolytic Cell | বাহ্যিক তড়িৎ শক্তির প্রয়োজন |
| Anode | সবসময় অক্সিডেশন হয় |
| Cathode | সবসময় রিডাকশন হয় |
গুরুত্বপূর্ণ প্রশ্ন (1 Mark):
- গ্যালভানিক সেলে কোন ইলেকট্রোডে রিডাকশন হয়?
➤ ক্যাথোডে। - ইলেকট্রোলাইটিক সেল কোন ধরণের বিক্রিয়া?
➤ অস্বতঃস্ফূর্ত। - নার্নস্ট সমীকরণ কী বোঝায়?
➤ ইলেকট্রোড পোটেনশিয়াল নির্ণয়ের সমীকরণ। - Specific Conductance-এর একক কী?
➤ S cm⁻¹
উপসংহার
তড়িৎ রসায়ন একটি গুরুত্বপূর্ণ অধ্যায় যা ইলেকট্রনের প্রবাহ, রাসায়নিক বিক্রিয়া এবং বিদ্যুৎ শক্তির সম্পর্ককে বিশ্লেষণ করে। গ্যালভানিক ও ইলেকট্রোলাইটিক সেল এর মধ্যে পার্থক্য বোঝা ও পরিবাহিতার ধারণা এই অধ্যায়ের মূল বিষয়বস্তু।