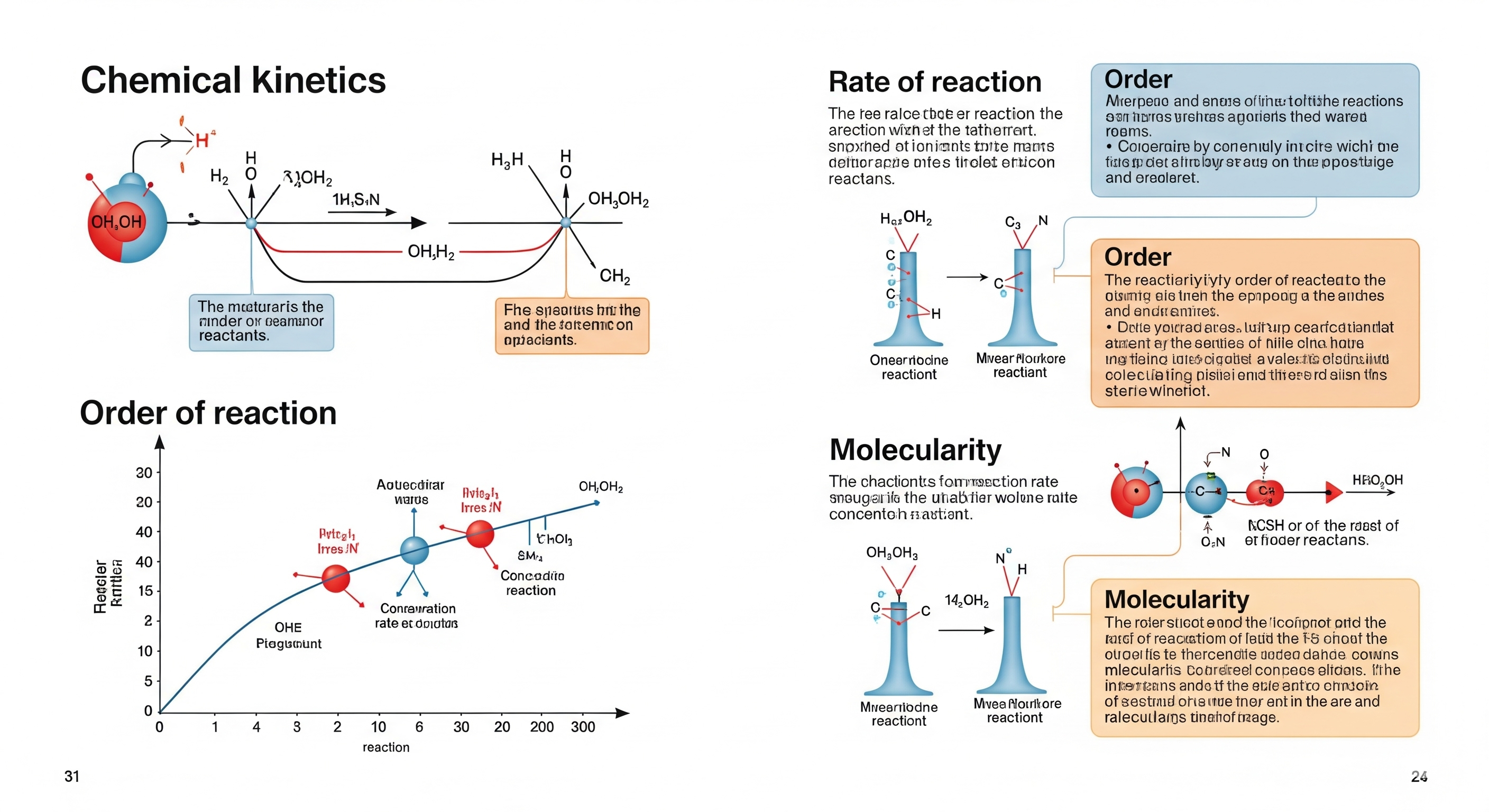
রাসায়নিক গতি (Chemical Kinetics) এমন একটি শাখা, যা রাসায়নিক বিক্রিয়া কীভাবে এবং কত দ্রুত ঘটে তা বিশ্লেষণ করে। এই অধ্যায়ে আমরা বিক্রিয়ার গতি (Rate of Reaction), আদেশ (Order) এবং আণবিকতা (Molecularity) সম্পর্কে বিস্তারিত জানব।
অধ্যায়ের মূল বিষয়বস্তু (Main Topics)
1. বিক্রিয়ার গতি (Rate of Reaction)
বিক্রিয়ার গতি হল কোন রাসায়নিক বিক্রিয়ায় বিক্রিয়াশীল পদার্থের ঘনত্ব পরিবর্তনের হার।
গড় গতি (Average Rate):
Average rate=Δ[P]Δt=−Δ[R]Δt\text{Average rate} = \frac{\Delta [P]}{\Delta t} = -\frac{\Delta [R]}{\Delta t}
তাত্ক্ষণিক গতি (Instantaneous Rate):
Instantaneous rate=∣d[R]dt∣=∣d[P]dt∣\text{Instantaneous rate} = \left| \frac{d[R]}{dt} \right| = \left| \frac{d[P]}{dt} \right|
চিত্র: গতি বনাম সময়ের গ্রাফ
| সময় (t) | বিক্রিয়ার গতি (Rate) |
|---|---|
| 0 | সর্বোচ্চ |
| সময় বাড়ার সাথে | কমে যায় |
2. গতি নির্ধারণের কারণসমূহ (Factors Affecting Reaction Rate)
- তাপমাত্রা
- ঘনত্ব (Concentration)
- দ্রাবকের প্রকৃতি
- অনুঘটক (Catalyst)
- চাপ (গ্যাসীয় বিক্রিয়ায়)
- পৃষ্ঠদেশ (Surface area)
3. গতি নির্ধারণের সূত্র (Rate Law or Rate Equation)
Rate Law:
Rate=k[A]x[B]y\text{Rate} = k [A]^x [B]^y
এখানে,
- kk = গতি ধ্রুবক (Rate constant)
- x,yx, y = প্রতিক্রিয়ার আদেশ (Order of reaction)
4. প্রতিক্রিয়ার আদেশ (Order of Reaction)
আদেশ (Order) হল কোন বিক্রিয়ায় অংশগ্রহণকারী বিভিন্ন পদার্থের ঘনত্বের উপর নির্ভরশীলতা প্রকাশ করে।
উদাহরণ:
Rate=k[A]1[B]2\text{Rate} = k [A]^1 [B]^2
এখানে আদেশ = 1 + 2 = 3 (Third order reaction)
সাধারণ আদেশ:
| Order | বৈশিষ্ট্য |
|---|---|
| Zero | গতি ঘনত্বের উপর নির্ভর করে না |
| First | গতি সরলরৈখিকভাবে বাড়ে |
| Second | দ্বিগুণ হারে পরিবর্তন ঘটে |
5. আণবিকতা (Molecularity of Reaction)
আণবিকতা হল প্রতিক্রিয়ার একটি ধাপে জড়িত আণবিক কণার সংখ্যা।
বৈশিষ্ট্য:
- সর্বদা পূর্ণ সংখ্যা হয় (1, 2, 3)
- প্রাথমিক প্রতিক্রিয়া ধাপে নির্ধারিত হয়
- আণবিকতা কখনো শূন্য বা ভগ্নাংশ হয় না
| ধরণের বিক্রিয়া | আণবিকতা | উদাহরণ |
|---|---|---|
| এক-আণবিক | 1 | A→ProductA → Product |
| দ্বি-আণবিক | 2 | A+B→ProductA + B → Product |
| ত্রি-আণবিক | 3 | A+B+C→PA + B + C → P |
6. শূন্য ও প্রথম আদেশের বিক্রিয়া (Zero and First Order Reaction)
শূন্য আদেশের বিক্রিয়া (Zero Order):
- গতি নির্ভর করে না প্রতিক্রিয়াশীল পদার্থের ঘনত্বের উপর
- Rate = k
প্রথম আদেশের বিক্রিয়া (First Order):
- Rate ∝ [A]
- Rate=k[A]\text{Rate} = k[A]
- k=2.303tlog([A]0[A])k = \frac{2.303}{t} \log\left(\frac{[A]_0}{[A]}\right)
Half-life for 1st order:
t1/2=0.693kt_{1/2} = \frac{0.693}{k}
এটি ঘনত্বের উপর নির্ভর করে না।
টেবিল: আদেশ বনাম আণবিকতা তুলনা
| বৈশিষ্ট্য | আদেশ (Order) | আণবিকতা (Molecularity) |
|---|---|---|
| নির্ধারণ কিভাবে? | পরীক্ষানির্ভর | তত্ত্বভিত্তিক (mechanism) |
| পূর্ণ সংখ্যা? | না (ভগ্নাংশ হতে পারে) | হ্যাঁ |
| শূন্য হতে পারে? | হ্যাঁ | না |
| নির্ধারণ হয় কোথায় | Rate law থেকে | Elementary step থেকে |
সংক্ষিপ্ত নোটস (Summary Notes)
- গতি নির্ভর করে ঘনত্ব, তাপমাত্রা, অনুঘটক ইত্যাদির উপর।
- আদেশ পরীক্ষামূলক, আণবিকতা তাত্ত্বিক।
- আদেশ ভগ্নাংশ হতে পারে, আণবিকতা নয়।
- গতি নির্ধারণের সূত্র থেকে k বের করে বিক্রিয়ার আদেশ নির্ণয় করা যায়।